Profa. Dra. Denise Morais da Fonseca
Laboratório de Imunologia de Mucosas
Telefone: +55 (11) 2648 8415
E-mail: denisefonseca@usp.br
Lattes: http://lattes.cnpq.br/1717770435586287
Google Scholar: https://scholar.google.com.br/citations?user=Iax_C2oAAAAJ&hl=en
Linhas de Pesquisa:
Eixo intestino-pulmão: mecanismos envolvidos na comunicação imunológica entre os tecidos de barreira durante o desenvolvimento de doenças.
Os tecidos de mucosa/barreiras possuem um sistema imunológico próprio de cada barreira com mecanismos efetores específicos para responder adequadamente à enorme gama de desafios regionais e, ao mesmo tempo, sustentar a homeostase tecidual. Nesse sentido, cada tecido de barreira possui células e mediadores especializados na efetuação e regulação da resposta imune, prevenindo assim danos teciduais. Classicamente, são descritos subtipos de células dendríticas, de linfócitos T e de linfócitos B produtores de anticorpos. Nosso grupo de pesquisa tem trabalhado na identificação de mecanismos não clássicos que atuam não apenas na manutenção da homeostase tecidual, mas também na comunicação entre os tecidos de barreira, como o intestino e o pulmão. A importância do eixo intestino-pulmão no controle e na promoção de doenças tem sido estudada em diferentes contextos, com foco em mecanismos envolvendo o trânsito celular, alterações na composição da microbiota e de metabólitos microbianos. Neste contexto, no Laboratório de Imunologia de Mucosas estudamos como episódios de infecção que afetam a estrutura do mesentério e vasos linfáticos acabam por interferir na imunidade e metabolismo do hospedeiro e na integração da resposta imune entre os diferentes tecidos de barreira. Nossa hipótese de trabalho é a de que os mecanismos que medeiam a comunicação imunológica entre as mucosas intestinais e pulmonares possuem um ponto de confluência no mesentério. Diante desta hipótese, visamos compreender os mecanismos envolvidos no diálogo imunológico entre os tecidos da mucosa, em especial o intestino e o pulmão estudando o impacto funcional dos desafios ambientais infecciosos e não infecciosos no intestino para a imunidade pulmonar e vice-versa, com foco no envolvimento da microbiota e seus metabólitos, compartimentos de tecido adiposo adjacentes, vasos linfáticos e microRNAs. Como objetivo final desta linha de pesquisa, esperamos estabelecer novos paradigmas para a manutenção da integridade tecidual e imunidade nos tecidos de barreira.
‘Cicatriz Imunológica’ pós-infecção intestinal no desenvolvimento de desordens metabólicas: estudo das interações entre a microbiota e sistema imunológico do mesentério
Durante o último século, mudanças no estilo de vida da população, incluindo melhorias nas condições sanitárias, uso de vacinas, antibióticos, suplementos nutricionais e disponibilidade de dietas ricas em energia, não apenas melhoraram a qualidade de vida das pessoas, mas também alteraram a maneira como o hospedeiro responde a infecções. Apesar disto, casos de infecção aguda ainda são bastante comuns em todo o mundo, particularmente aqueles que acometem áreas do corpo que são mais expostas ao ambiente, como é o caso da mucosa intestinal. Utilizando modelos experimentais de infecções agudas que acometem regiões de mucosa estudamos como tais episódios infecciosos podem ter consequências imunológicas e metabólicas permanentes para o hospedeiro. Determinados episódios de infecção podem deixar uma “cicatriz imunológica” no mesentério. Esta cicatriz, está relacionada ao remodelamento do mesentério, com ruptura dos vasos linfáticos (Figura 1), inflamação crônica do tecido adiposo mesentérico (Figura 2) e desvio da migração de células dendríticas intestinais (Figura 3). Como consequência destes eventos, ocorre indução de imunidade à componentes da microbiota intestinal, desenvolvimento de doenças inflamatórias intestinais e desordens metabólicas. No Laboratório de Imunologia de Mucosas pretendemos estudar as interações microbiota – sistema imunológico – sistema neuroendócrino que determinam o desenvolvimento desta “cicatriz imunológica” no mesentério.
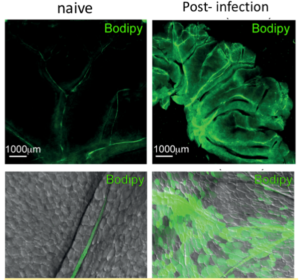
Figura 1: Identificação de vasos linfáticos mesentéricos de camundongo após gavagem de Bodipy FL C16 (em verde) em animais naïves ou após a infecção gastrointestinal com a bactéria Yersinia pseudotuberculosis
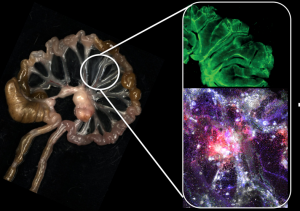
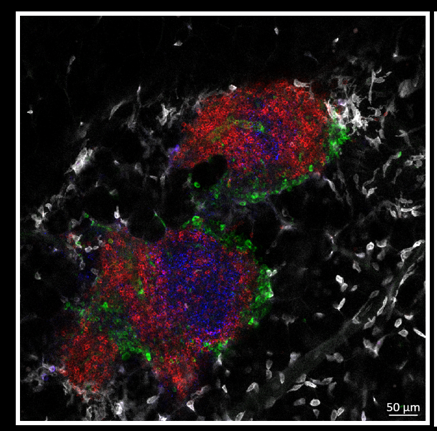
Figura 2: ‘Cicatriz Imunológica’ desenvolvida por camundongos previamente infectados com a bactéria Yersinia pseudotuberculosis. Imagem à esquerda representa o intestino, mesentério e linfonodos mesentéricos pós-infecção. À direita, imagem superior mostra a lesão dos vasos linfáticos mesentéricos (em verde) e a imagem inferior mostra infiltrado inflamatório no mesentério pós-infecção (verde:CX3CR1, azul:CD11b, vermelho: CD45, branco CD11c).
Estudo dos mecanismos associados com a integridade e reparo dos vasos linfáticos mesentéricos
Os vasos linfáticos mesentéricos exercem funções essenciais na absorção de vitaminas e lipídeos da dieta e, ao mesmo tempo, sevem de vias para o tráfego de células dendríticas que carregam antígenos intestinais para serem apresentados a linfócitos T nos linfonodos mesentéricos. Este processo garante a comunicação imunológica na mucosa intestinal. Fatores externos como infecção e alterações de dieta podem interferir na integridade e função destes vasos linfáticos. Neste projeto, estudamos os mecanismos associados ao aumento de permeabilidade linfática permanente ou transitória durante processos infecciosos ou inflamatórios (como na colite e câncer) intestinais ou durante alterações de dieta. A partir destes resultados pretendemos entender como tais processos podem interferir temporariamente ou de maneira permanente na função do sistema imunológico associado ao intestino e outras mucosas.
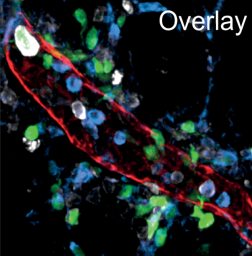
Figura 3: Detalhe estrutural de vaso linfático mesentérico e células mielóides associadas. Vermelho:Lyve1, verde:CD11c, azul:CD11b, branco: MHC II.
Efeito de alterações de dieta sobre a microbiota e sobre o sistema imunológico associado às mucosas intestinais e pulmonares
A mucosa intestinal é o maior tecido do corpo humano exposto ao meio externo. Diferentes fatores atuam diretamente sobre o intestino e interferem na homeostase das células do sistema imunológico associado ao intestino. Tais fatores incluem infecções, estresse e alterações de dieta. Estudos recentes têm mostrado alterações de homeostase do sistema imunológico associado ao intestino, bem como na microbiota intestinal, possuem reflexo em tecidos distantes, particularmente outros tecidos de mucosa. Embora alguns indivíduos precisem de determinadas restrições alimentares em função de doenças metabólicas ou imunológicas, a maior parte das pessoas que se submetem a alterações de dieta fazem isso de maneira não supervisionada. Pouco se sabe sobre os efeitos a longo prazo de alterações de dieta sobre o sistema imunológico associado ao intestino e às demais mucosas. Neste projeto estudamos como alterações de dieta incluindo o uso dedietas cetogênicas (low carb), hipoprotícias, hiperlipídicas, ricas em frutose ou hipercolesterolêmicas interferem na função do sistema imunológico associado ao intestino e ao pulmão.
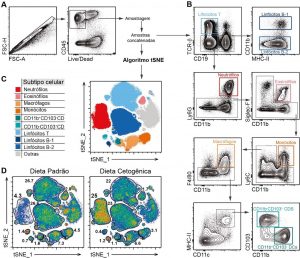
Figura 4: Efeito do tratamento de camundongos com dieta cetogênica sobre as populações de leucócitos pulmonares
Contribuição do omento para a imunidade da mucosa intestinal
Diferentes componentes celulares e moleculares atuam para a imunidade nos tecidos de barreira. Tais componentes incluem células do sistema imunológico, epitélios, peptídeo antimicrobianos, anticorpos e a própria microbiota. Estes mecanismos promovem uma segregação seletiva entre hospedeiro e ambiente externo e fornecem proteção contra a entrada de patógenos e, ao mesmo tempo, previnem a elaboração de respostas contra antígenos inócuos (como alimentos, alérgenos e a microbiota). Recentemente, o tecido adiposo visceral vem sendo descrito como um componente muito importante da barreira mucosa intestinal. O tecido adiposo branco alberga uma vasta variedade de células do sistema imunológico, incluindo células de memória específicas para antígenos intestinais. Este projeto visa compreender a contribuição do omento para os mecanismos efetores imunológicos na mucosa intestinal. Pretendemos estudar como a infecção por diferentes tipos de patógenos, bactérias, vírus ou protozoários, interfere na estrutura dos vasos linfáticos no omento, assim como na dinâmica da ativação das células do sistema imunológico residentes no omento.
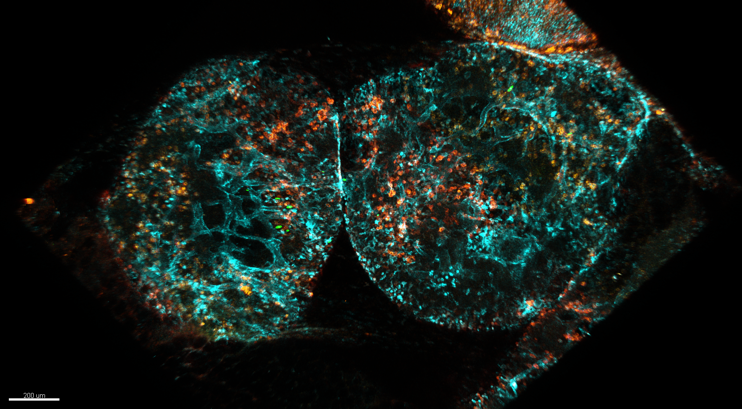
Figura 5: Estruturas imunológicas presentes no omento. À esquerda, remodelamento de vasos linfáticos (em ciano) pós-infecção intestinal. À direita, aglomerado celular (milky spot) composto por linfócitos B (vermelho e verde) T (azul) e macrófagos (branco).
Publicações mais recentes
Fonseca DM, Hand TW, Han SJ, Gerner MY, Byrd AL, Harrison OJ, Quinones M, Trinchieri G, Brodsky IE, Germain RN, Randolph GJ, Belkaid Y. Microbiota-dependent sequelae of acute infection compromises tissue-specific immunity. Cell. 2015 Oct 8;163(2):354-66.
Bhattacharjee A, Burr AHP, Overacre-Delgoffe AE, Tometich JT, Yang D, Huckestein BR, Linehan JL, Spencer SP, Hall JA, Harrison OJ, Fonseca DM,Belkaid Y, Hand TW. Enteropathy-induced regulatory T cells inhibit intestinal CD4+ T 1 cell responses against oral vaccines. Immunity, 2021.
de Campos Fraga-Silva TF, Mimura LAN, de Oliveira LRC, Dos Santos Toledo JH, Borim PA, Zorzella-Pezavento SFG, Alonso DP, Ribolla PEM, de Oliveira CAF, da Fonseca DM, Villablanca EJ, Sartori A. Selenization of S. cerevisiae increases its protective potential in experimental autoimmune encephalomyelitis by triggering an intestinal immunomodulatory loop. Sci Rep. 2020.
Nascimento D, Viacava PR, Ferreira RG, Damaceno MA, Piñeros AR, Melo PH, Donate PB, Toller-Kawahisa JE, Zoppi D, Veras FP, Peres RS, Menezes-Silva L, Caetité D, Oliveira AER, Castro IMS, Kauffenstein G, Nakaya HI, Borges MC, Zamboni DS, Fonseca DM, Paschoal JAR, Cunha TM, Quesniaux V, Linden J, Queíroz CunhaF, Ryffel B, Alves-Filho JC. Sepsis expands a CD39 + plasmablast population that promotes immunosuppression via adenosine-mediated inhibition of macrophage antimicrobial activity. Immunity, 2021.
Menezes-Silva L, Fonseca DM**. Connecting the dots in type 1 diabetes: The role for gut-pancreas axis. J Leukoc Biol. 2019
Henrique MO, Neto LS, Assis JB, Barros MS, Capurro ML, Lepique AP, Fonseca DM**, Sá-Nunes A**. Evaluation of inflammatory skin infiltrate following Aedes aegypti bites in sensitized and non-sensitized mice reveals saliva-dependent and immune-dependent phenotypes. Immunology. 2019
Nunes FPB, Alberca-Custódio RW, Gomes E, Fonseca DM, Yokoyama NH, Labrada A, Russo M. TLR9 agonist adsorbed to alum adjuvant prevents asthma-like responses induced by Blomia tropicalis mite extract. J Leukoc Biol. 2019
Fachi JL, Felipe JS, Pral LP, da Silva BK, Corrêa RO, de Andrade MCP, da Fonseca DM, Basso PJ, Câmara NOS, de Sales E Souza ÉL, Dos Santos Martins F, Guima SES, Thomas AM, Setubal JC, Magalhães YT, Forti FL, Candreva T, Rodrigues HG, de Jesus MB, Consonni SR, Farias ADS, Varga-Weisz P, Vinolo MAR. Butyrate Protects Mice from Clostridium difficile-Induced Colitis through an HIF-1-Dependent Mechanism. Cell Reports. 2019.
Han SJ, Zaretsky AG, Andrade-Oliveira V, Collins N, Fonseca DM, Dzutsev A, Shaik J, Harrison OJ, Tamoutounour S, Byrd AL, Smelkinson M, Bouladoux N, Bliska J, Brenchley JM, Brodsky IE, Belkaid Y. The white adipose tissue is a hub for memory T cells and promotes memory responses. Immunity, 2017.
Piñeros AR, Campos LW, Fonseca DM, Bertolini TB, Gembre AF, Prado RQ, Alves-Filho JC, Ramos, SG, Russo M, Bonato VLD. M2 macrophages or IL-33 treatment attenuate ongoing Mycobacterium tuberculosis infection. Sci Rep. 2017 in press.
Wowk PF, Franco LH, Fonseca DM, Paula MO, Vianna ÉD, Wendling AP, Augusto VM, Elói-Santos SM, Teixeira-Carvalho A, Silva FD, Vinhas SA, Martins-Filho OA, Palaci M, Silva CL, Bonato VL. Mycobacterial Hsp65 antigen upregulates the cellular immune response of healthy individuals compared to tuberculosis patients. Hum Vaccin Immunother. 2017
Munhoz TD, Anai LA, Fonseca DM, Semolin LM, Sueiro FR, Tinucci-Costa M. Regulatory T cells in dogs with multicentric lymphoma: peripheral blood quantification at diagnosis and after initial stage chemotherapy. Arquivo Brasileiro de Medicina Veterinária e Zootecnia (Online), v. 68, p. 1-9, 2016.
Edwards, Justin P. ; Hand, Timothy W. ; Da Fonseca, Denise Morais ; Glass, Deborah D. ; Belkaid, Yasmine ; Shevach, Ethan M. . The GARP/Latent TGF-β1 complex on Treg cells modulates the induction of peripherally derived Treg cells during oral tolerance. European Journal of Immunology, v. in, p. in press, 2016.
Askenase MH, Han SJ, Byrd AL, Fonseca DM, Bouladoux N, Wilhelm C, Konkel JE, Hand TW, Lacerda-Queiroz N, Su XZ, Trinchieri G, Grainger JR, Belkaid Y. Bone marrow resident NK cells prime monocytes for regulatory function during infection. Immunity. 2015 Jun 16;42(6):1130-42.
Fonseca DM, Wowk PF, Paula MO, Gembre AF, Turato W, Campos LW, Silva CL, Ramos SG, Horn C, Marchal G, Arruda KL, Russo M, Bonato VLD. Requirement of MyD88 and Fas pathways for the efficacy of experimental allergen-free therapy. Allergy. 2015 Mar;70(3):275-84.
Grainger JR, Askenase MH, Guimont-Desrochers F, Fonseca DM, Belkaid Y. Contextual functions of antigen-presenting cells in the gastrointestinal tract. Immunol Rev. 2014 May;259(1):75-87. doi: 10.1111/imr.12167.
Faustino L, Fonseca DM, Florsheim EB, Resende RR, Lepique AP, Faquim-Mauro E, Gomes E, Silva JS, Yagita H, Russo M. Tumor necrosis factor-related apoptosis-inducing ligand mediates the resolution of allergic airway inflammation induced by chronic allergen inhalation. Mucosal Immunol. 2014 Feb 26. doi: 10.1038/mi.2014.9.
Faustino L, da Fonseca DM, Takenaka MC, Mirotti L, Florsheim EB, Guereschi MG, Silva JS, Basso AS, Russo M. Regulatory T cells migrate to airways via CCR4 and attenuate the severity of airway allergic inflammation. J Immunol. 2013 Mar 15;190(6):2614-21. doi: 10.4049/jimmunol.Lucas
Fonseca DM, Wowk PF, Paula MO, Campos LW, Gembre AF, Turato WM, Ramos SG, Dias-Baruffi M, Barboza R, Gomes E, Silva CL, Russo M, Bonato VL. Recombinant DNA immunotherapy ameliorate established airway allergy in a IL-10 dependent pathway. Clin Exp Allergy. 2012 Jan;42(1):131-43.
Fonseca DM, Paula MO, Wowk PF, Campos LW, Gembre AF, Turato WM, Ramos SG, Dias-Baruffi M, Barboza R, Gomes E, Horn C, Marchal G, Arruda LK, Russo M, Bonato VL. IFN-γ-mediated efficacy of allergen-free immunotherapy using mycobacterial antigens and CpG-ODN. Immunol Cell Biol. 2011 Oct;89(7):777-85.
Fonseca DM, Trombone AP, Repeke CE, Avila-Campos MJ, Coelho-Castelo AA, Silva JS, Campanelli AP, Deperon Bonato VL, Garlet GP. Functional interferences in host inflammatory immune response by airway allergic inflammation restrain experimental periodontitis development in mice. J Clin Periodontol. 2011 Feb;38(2):131-41.
Morais Fonseca D, Rosada RS, e Paula MO, Wowk PF, Franco LH, Soares EG, Silva CL, Deperon Bonato VL. Experimental tuberculosis: designing a better model to test vaccines against tuberculosis. Tuberculosis (Edinb). 2010 Mar;90(2):135-42.
Fonseca DM, Silva CL, Wowk PF, Paula MO, Ramos SG, Horn C, Marchal G, Bonato VL. Mycobacterium tuberculosis culture filtrate proteins plus CpG Oligodeoxynucleotides confer protection to Mycobacterium bovis BCG-primed mice by inhibiting interleukin-4 secretion. Infect Immun. 2009 Dec;77(12):5311-21.
Fonseca DM, Silva CL, Paula MO, Soares EG, Marchal G, Horn C, Bonato VL. Increased levels of interferon-gamma primed by culture filtrate proteins antigen and CpG-ODN immunization do not confer significant protection against Mycobacterium tuberculosis infection. Immunology. 2007 Aug;121(4):508-17.
Copyright © 2024 Programa de Pós-Graduação em Imunologia | Produzido por SCS - Mídias Online