MODELO ATÔMICO DE DALTON
O modelo atômico de Dalton é ponto de partida da aventura pelo mundo dos átomos! Imagine uma época onde a química estava mais para alquimia do que para a ciência que conhecemos hoje. Hoje vamos embarcar numa jornada emocionante para conhecer o modelo atômico de Dalton. No século XIX, a química estava prestes a ganhar uma nova perspectiva, tudo graças a um grande cientista chamado John Dalton. John Dalton, em 1808, trouxe a ideia revolucionária de que tudo ao nosso redor é feito de minúsculas partículas chamadas átomos, como se a matéria fosse composta por blocos de construção invisíveis.
Cada átomo, segundo Dalton, é como uma peça única de um quebra-cabeça cósmico, cada qual com suas propriedades distintas, mas todos intrinsecamente idênticos dentro de sua espécie. Dalton acreditava piamente que os átomos eram indestrutíveis e imutáveis, mas, quando ocorriam reações químicas, os átomos simplesmente mudavam de lugar, como peças móveis num tabuleiro, rearranjando-se para formar novas substâncias. Esse modelo atômico, conhecido como modelo da “bola de bilhar”, admite o átomo como uma esfera maciça, indivisível e indestrutível. Com isso, o cientista propôs princípios que explicam a matéria e as reações químicas: Quando os átomos se unem para formar substâncias, eles não sofrem mudanças em sua estrutura interna. Isso significa que, durante uma reação química, os átomos apenas se rearranjam e se combinam de maneiras diferentes, mas suas identidades individuais permanecem intactas. Por exemplo, se você tem átomos de hidrogênio (H) e átomos de oxigênio (O) se combinando para formar moléculas de água (H2O), os átomos de hidrogênio continuam sendo átomos de hidrogênio e os átomos de oxigênio continuam sendo átomos de oxigênio, apenas sua organização espacial é alterada.
Assim, a matéria é composta por átomos, que são as menores unidades de um elemento químico que ainda mantêm as propriedades desse elemento. Além disso, os átomos de um mesmo elemento químico são idênticos entre si em termos de suas propriedades atômicas.

MODELO ATÔMICO DE THOMSON
O Modelo Atômico de Thomson, pioneiro em sua época, lançou as bases para uma nova compreensão da estrutura atômica. Imagine-se mergulhando na mente criativa do físico inglês J.J. Thomson, enquanto ele investiga os misteriosos raios catódicos em seu laboratório. Em meio a faíscas elétricas e tubos de vácuo, Thomson teve uma epifania científica que mudaria para sempre nossa percepção do universo microscópico.
Thomson propôs um modelo revolucionário, comparando o átomo a uma deliciosa sobremesa britânica: o pudim de passas. Nesse “pudim” as passas representam os elétrons, e o restante do pudim, a massa, simboliza a carga positiva. Neste intrigante cenário, Thomson nos apresenta uma nova visão do átomo: uma esfera elétrica com uma carga positiva uniformemente distribuída com elétrons negativos como as saborosas passas de um pudim. Esses elétrons, embora livres para se movimentar, são mantidos em equilíbrio pela atração do núcleo positivo. Thomson descobriu algo realmente surpreendente: a existência do elétron, a partícula elementar responsável pela eletricidade. Assim, Thomson desafiou as noções antigas de um átomo indivisível de Dalton e nos mostrou que o átomo é mais do que uma esfera maciça e inerte – é um palco de atividade elétrica vibrante, onde elétrons dançam em torno de um núcleo misterioso.
Em essência, o Modelo Atômico de Thomson nos oferece um olhar fascinante sobre o microcosmo invisível que constitui toda a matéria. É uma jornada de descoberta que nos convida a explorar os mistérios da eletricidade e da estrutura atômica, tudo isso embrulhado em uma deliciosa analogia de pudim!

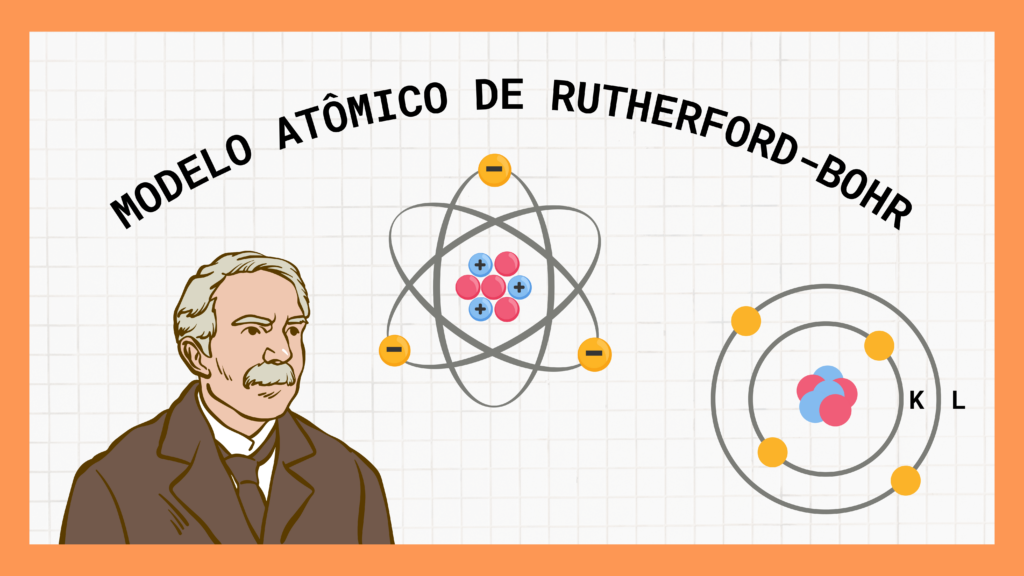
MODELO ATÔMICO DE RUTHERFORD-BOHR
Em 1911, o físico neozelandês Ernest Rutherford mergulhou de cabeça em um experimento ousado: bombardear uma finíssima lâmina de ouro com partículas alfa, emitidas por uma amostra de polônio. Imagine só, uma lâmina de ouro tão fina que uma única partícula alfa poderia atravessá-la! E assim, com uma mistura de audácia e curiosidade, Rutherford esquadrinhou o átomo em busca de seus segredos mais íntimos.
Os resultados foram tão surpreendentes quanto inesperados. Rutherford descobriu que algumas das partículas alfa passavam pela lâmina de ouro sem sofrerem nenhum desvio, como se estivessem dando um passeio casual em um parque, enquanto outras eram completamente bloqueadas. Esse comportamento intrigante sussurrava ao ouvido do cientista, revelando pistas que desafiavam as concepções então aceitas sobre a estrutura do átomo. Assim, Rutherford concluiu que o átomo não podia ser uma bola sólida, como Dalton e Thomson haviam sugerido e sim, um constituído de duas regiões distintas: o núcleo, denso e carregado positivamente, onde residiam os prótons, e a eletrosfera, uma vasta arena onde os elétrons realizavam suas acrobacias elétricas.
Este modelo atômico, chamado de modelo planetário, fazia com que o átomo se assemelhasse a um sistema solar em miniatura, com o núcleo desempenhando o papel do sol, irradiando energia positiva, e os elétrons girando alegremente ao seu redor, como planetas em suas órbitas. Posteriormente, um outro gênio da história, Niels Bohr, adicionou um toque de precisão ao modelo de Rutherford. Bohr estabeleceu as bases para uma nova compreensão do átomo. Ele descreveu as órbitas dos elétrons não como meros círculos aleatórios, mas como trajetórias determinadas, onde os elétrons se movem, pulando entre diferentes camadas de energia com uma agilidade impressionante. Essas camadas, representadas pelas letras K, L, M, N, O, P e Q, formavam uma espécie de “escadaria quântica”, onde os elétrons podiam subir ou descer, emitindo luz ou calor no processo.
Assim, o modelo de Rutherford-Bohr, como ficou conhecido, nos deu uma visão mais refinada e precisa do átomo. Não era mais apenas um sistema solar em miniatura, mas sim um palco dinâmico, onde os elétrons dançavam entre níveis de energia, emitindo flashes de luz e calor no seu trajeto. Este modelo não apenas nos ajudou a entender a estrutura do átomo, mas também nos abriu as portas para um novo mundo de possibilidades na física quântica. Uma verdadeira revolução na ciência, tudo graças ao arrojo de um homem e sua insaciável sede de conhecimento.