

Prof. Dr. Jean Pierre Schatzmann Peron
Título: Professor Doutor
Laboratório: Interações Neuroimunes
Lattes: http://lattes.cnpq.br/8556721425351491
E-mail: jeanpierre@usp.br
 Dentre as áreas da imunologia, a NEUROIMUNOLOGIA é uma das mais promissoras, e também a que mais cresceu nos últimos anos. Podemos subdividi-la em NEUROIMUNOMODULAÇÃO e NEUROINFLAMAÇÃO. A forma mais comum de neuroimunomodulação está na ação de NEUROTRANSMISSORES E HORMÔNIOS sobre células do sistema imune. Adrenalina, dopamina, serotonina, glutamato, leptina são apenas algumas dessas moléculas, capazes de agirem sobre linfócitos, neutrófilos, macrófagos, células dendríticas, entre muitas outras células do sistema imune. Já no contexto de NEUROINFLAMAÇÂO células infiltrantes alcançam o sistema nervoso, montando uma resposta imune local. Neste caso, não somente a peculiaridade dos neurotransmissores é relevante, mas também a presença de células residentes do SNC, como astrócitos, micróglia e neurônios.
Dentre as áreas da imunologia, a NEUROIMUNOLOGIA é uma das mais promissoras, e também a que mais cresceu nos últimos anos. Podemos subdividi-la em NEUROIMUNOMODULAÇÃO e NEUROINFLAMAÇÃO. A forma mais comum de neuroimunomodulação está na ação de NEUROTRANSMISSORES E HORMÔNIOS sobre células do sistema imune. Adrenalina, dopamina, serotonina, glutamato, leptina são apenas algumas dessas moléculas, capazes de agirem sobre linfócitos, neutrófilos, macrófagos, células dendríticas, entre muitas outras células do sistema imune. Já no contexto de NEUROINFLAMAÇÂO células infiltrantes alcançam o sistema nervoso, montando uma resposta imune local. Neste caso, não somente a peculiaridade dos neurotransmissores é relevante, mas também a presença de células residentes do SNC, como astrócitos, micróglia e neurônios.
Em nosso laboratório, tentemos compreender algumas dessas INTERAÇÕES NEUROIMUNES. Para tanto, modelos experimentais de doenças humanas, como a Esclerose Múltipla e a infecção pelo vírus Zika. Mais especificamente, avaliamos vários parâmetros destas interações, como populações celulares de linfócitos, como Th1, Th17 e Tregs; ativação de macrófagos e células da micróglia; secreção de citocinas; fatores de transcrição; perfil de expressão gênica, replicação viral, presença de proteínas virais, entre muitos outros.
Recentemente iniciamos nossos estudos na patogenia da síndrome congênita do Zika vírus, tendo sido o nosso laboratório o primeiro a estabelecer um modelo experimental em animais selvagens. Nossos dados mostram que o vírus foi capaz de atravessar a placenta e causar lesões corticais nos fetos de animais SJL1. Fato não observados em animais C57Bl/6. Demonstramos também que as lesões se davam por uma ampla ativação de morte celular por apoptose e autofagia, associada à presença viral. Além disso, em colaboração com o laboratório do Prof. Dan Barouch (Harvard) alicerçamos o desenvolvimento de 3 plataformas vacinais contra Zika, sendo que uma delas já se encontra em testes clínicos. As mesmas foram capazes de reduzir a zero a viremia e a carga viral em 3 linhagens de camundongos2, e também em macacos Rhesus3.
Em suma, focamos em desvendar mecanismos imunes que possam não contribuir para uma melhor compreensão da fisiopatogenia de doenças neuroinflamatórias ou degenerativas do SNC, mas também alicerçar possíveis abordagens terapêuticas ou vacinais.
Doutoranda: Laura Caroline de Faria
Projeto: Caracterização do Papel Imunomodulador de Microvesículas Derivadas de Células Tronco Mesenquimais de Útero de Camundongos C57Bl/6 no Modelo de Encefalomielite Experimental Autoimune
Resumo: Esclerose Múltipla é uma doença multifatorial, predominantemente auto-imune, que atinge o Sistema Nervoso Central (SNC). Embora não se conheça ao certo qual a etiologia da doença, sabe-se que é mediada por mecanismos imunológicos locais e sistêmicos, e acredita-se que inicia com a ativação de linfócitos T por Células Apresentadoras de Antígenos (APC) na periferia, os quais migram e infiltram o SNC, onde encontram antígenos da bainha de mielina, levando ao aumento da produção de citocinas pró-inflamatórias e quimiocinas, que orquestram a inflamação e dano neuronal. As principais células envolvidas são as subpopulações de linfócitos TCD4+ do tipo Th1 e Th17, sendo as células Treg Foxp3+ essenciais para o controle da resposta.
As Células Tronco Mesenquimais (MSC) vêm sendo utilizadas em diversos ensaios clínicos para o tratamento de doenças imunes, sendo sua capacidade de secretar microvesículas (MV) e atuar sobre a população de Tregs ainda pouco estudada.
Por esses motivos, em meu projeto, pretendemos avaliar a capacidade imunomoduladora de Microvesículas advindas de Células Tronco Mesenquimais de Endométrio murino (meMSC-MV) sobre células imunes durante o modelo animal da Esclerose Múltipla, a Encefalomielite Autoimune Experimental (EAE).
Após o cultivo das me-MSC e isolamento de suas microvesículas, nós iremos realizar experimentos in vitro para avaliar o papel das microvesículas sobre células imunes e realizaremos a caracterização de miRNA’s, e in vivo, serão avaliados o escore clínico, a resposta imunológica local no SNC e sistêmica em células e citocinas séricas.
Vesículas Extracelulares são uma grande aposta terapêutica no futuro, e por isso esperamos elucidar a função de meMSC-MV no modelo de EAE e evidenciar suas características imunomodulatórias.
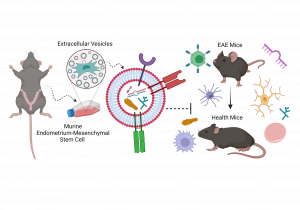
Figura: A hipótese do trabalho busca provar que microvesículas advindas de Células Tronco Mesenquimais de Endométrio murino (meMSC-MV) podem possuir um papel imunomodulador sobre células imunológicas no modelo experimental de Esclerose Múltipla (Encefalomielite Autoimune Experimental), podendo essa regulação ser mediada pela carga contida nas vesículas extracelulares, tais quais miRNAs, proteínas, lipídios e RNA.
Mestrando: Yan de Souza Angelo
Projeto: Caracterização da função mitocondrial em astrócitos primários durante a infecção por ZIKV em diferentes modelos experimentais.
Resumo: O Zika vírus (ZIKV) é um arbovírus pertencente ao gênero flavivírus descrito pela primeira vez em 1947 em macacos rhesus sentinelas nas proximidades da floresta de Zika, Uganda – África. No Brasil durante os anos de 2015 -2016, um grande número de bebês nascidos com microcefalia relacionada à infecção por ZIKV foi observado. Trabalhos demonstraram que o vírus é capaz de atravessar a placenta e atingir o cérebro fetal, causando a morte de células precursoras neuronais e subsequente redução do encéfalo e das medidas cranianas, sendo estas, características principais da SCZ. Os astrócitos são células chave no metabolismo e manutenção das funções neuronais, além de promoverem a detoxificação de neurotransmissores potencialmente tóxicos. Por muito tempo, acreditou-se que a mitocôndria era uma organela que exercia somente a respiração celular. Porém, nos últimos anos essa visão foi ampliada, sendo reconhecida a sua complexidade e interações nos mais diversos processos celulares, tendo envolvimento desde a homeostase de íons às respostas imunes. Uma vez que os astrócitos apresentam uma robustez metabólica devido às suas funções, é plausível imaginar que suas mitocôndrias sejam componentes chave no entendimento dos processos patológicos no SNC. Durante infecções virais como o ZIKV, ocorrem alterações no metabolismo celular a fim de promover a replicação viral. Nesse contexto, acreditamos que o estudo dos mecanismos moleculares envolvendo o estado mitocondrial em astrócitos durante uma infecção por ZIKV, pode gerar dados relevantes para elucidar os mecanismos patogênicos ainda desconhecidos da SCZ. Deste modo, facilitando a elaboração de intervenções terapêuticas para com os indivíduos afetados.
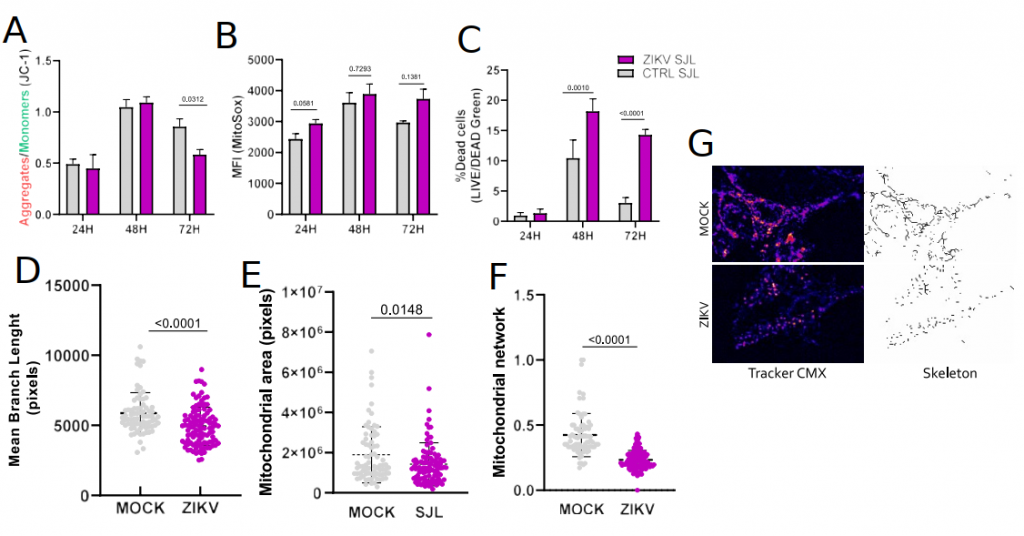
Figura: Os astrócitos infectados pelo ZIKV sofrem alterações dramáticas quanto a morfologia e função mitocondrial. A figura representa as alterações da infecção em animais SJL.
Pós-Doutorando: Patrick da Silva
Projeto: Resistência e Susceptibilidade na Síndrome Congênita do Zika Vírus
Resumo: A síndrome congênita do ZIKV afeta cerca de 17-23% das mulheres grávidas que se infectam durante a gestação, variando de região ou país. Corroborando tal observação, nós e outros grupos, demonstramos em modelos experimentais que algumas linhagens se mostram susceptíveis, enquanto outras são resistentes. Animais SJL prenhes infectadas em E10-E12 tiveram filhotes com restrição do crescimento intra-uterino (IUGR), comprometimento ocular, lesões do córtex cerebral e redução das medidas crânio encefálicas, enquanto animais C57Bl/6 foram totalmente resistentes. Sendo assim, temos como objetivo desvendar genes de resistência e susceptibilidade à síndrome congênita do ZIKV. Para tanto realizaremos o sequenciamento scRNAseq (single-cell RNA sequencing) de duas linhagens de camundongos, C57Bl/6 e SJL, resistente e suscetível, focando em células da resposta imune extraídas da placenta e células cerebrais do córtex frontal dos fetos. A análise do material oriundo da placenta se desenrolará em torno de genes importantes no controle da infecção, como IFNs do tipo I e seus receptores, assim como para moléculas de sua via de sinalização, como IRFs e TRIF. Enquanto que para as células do sistema nervoso serão avaliadas as mudanças no processo de neurogênese embrional. Além disso, os receptores de interação com o vírus também serão avaliados, como o TLR-3 e os receptores TAM (Tyro-3, Axl e MertK). Os dados serão analisados em paralelo, buscando as divergências e especificidades de ambos modelos experimentais. Os resultados obtidos auxiliarão para uma melhor compreensão dos mecanismos de resistência ou susceptibilidade à infecção.
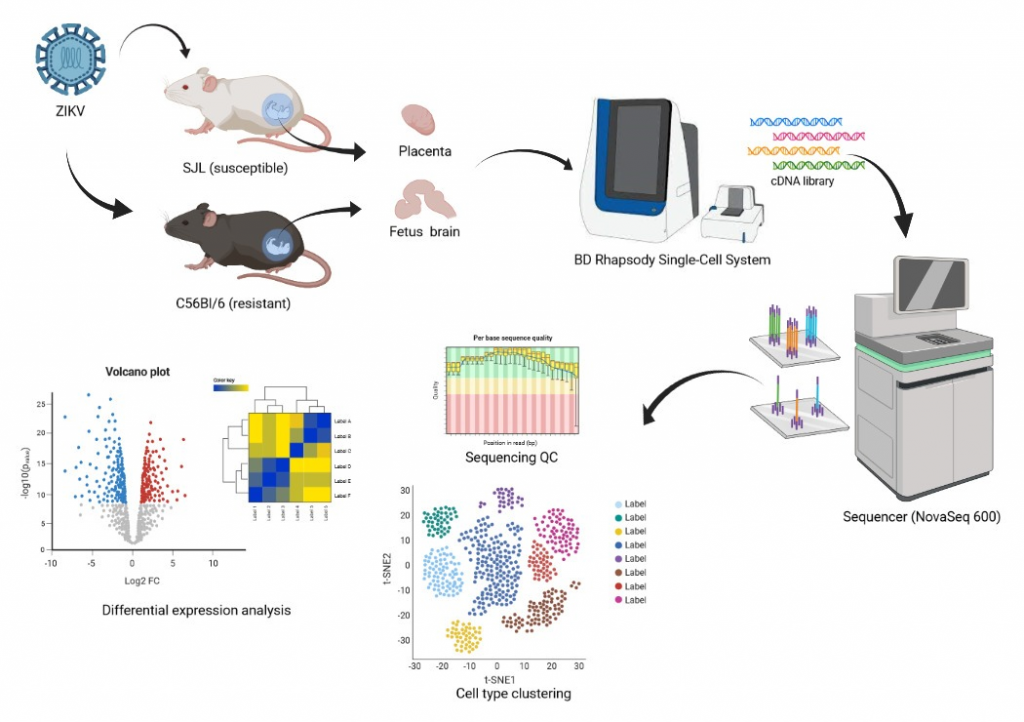
Figura: Pipeline do experimento de scRNAseq da placenta e cérebro de fetos infectados com ZIKV das linhagens resistentes e susceptíveis à infecção até a análise de bioinformática dos dados gerados pelo sequenciamento, compreendendo a clusterização de tipos celulares distintos com resposta específica e análise de expressão diferencial de genes-alvo.
Doutoranda: Carolina Manganeli Polonio
Título: Avaliação do papel dos microRNAs na Imunopatogênese da Microcefalia Causada Pelo Zika vírus em Modelos Experimentais
Resumo: As infecções virais sempre foram causa de doenças graves que repercutem no aumento das taxas de morbidade e mortalidade em todo o mundo. O Zika Vírus (ZIKV) é um flavivírus transmitido por mosquitos que leva a um notável comprometimento neurológico, que caracteriza a Síndrome Congênita do ZIKV (SCZ). Vários reguladores de processos biológicos estão envolvidos no desenvolvimento do SCZ, e os microRNAs (miRNAs) têm papel fundamental nesses processos. Os miRNAs são reguladores importantes, uma vez que formam o complexo de silenciamento RISC e interagem com sequências alvo de mRNA complementares para posterior repressão pós-transcricional. A importância dos miRNAs durante o desenvolvimento embrionário e a resposta imune antiviral é inquestionável, pois a diferenciação neuronal e glial é finamente orquestrada pela rede de miRNAs. Nesse contexto, muito pouco se sabe sobre a interação entre miRNAs e microcefalia causada pelo ZIKV. Neste trabalho, avaliamos de forma funcional os possíveis alvos dos miRNAs modulados pela infecção, com foco no neurodesenvolvimento e na resposta imune antiviral. Isso fornece dados extremamente importantes não apenas sobre a patogênese da microcefalia, mas também pode levantar possíveis alvos para intervenção terapêutica.
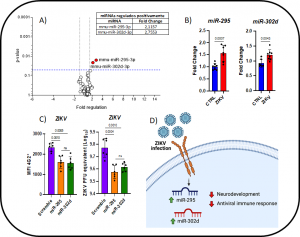
Figura: O ZIKV modula miRNAs que regulam genes relacionados com o neurodesenvolvimento e resposta imune antiviral. A,B) A infecção pelo ZIKV leva ao aumento da expressão dos miR-295 e miR-302d em astrócitos de SJL avaliada por A) PCR array e B) RT-PCR. C) A inibição dos miR-295 e miR-302d diminui a infecção pelo ZIKV. D) Resumo gráfico.
Mestrando: Brendo Rony Nunes Hyppolito
Projeto: Meta-análise da Expressão de Genes de Astrócitos no Sistema Nervoso Central em Quadros de Infecções e Doenças Neuroinflamatórias ou Neurodegenerativas
Resumo: O sistema nervoso central (SNC) é formado predominantemente por neurônios e células da glia que se comunicam por complexas redes de interação molecular. Os neurônios são responsáveis pela transmissão dos sinais nervosos, enquanto as células da glia podem ser divididas em micróglia, oligodendrócitos e astrócitos, responsáveis pela defesa/reparo, isolamento elétrico e suporte metabólico, respectivamente. Dentre estas, astrócitos têm vital importância, tanto como suporte estrutural e energético, mas também como importante player na resposta imune local. Além de expressarem uma série de receptores do sistema imune, como TLRs, NLRs entre outros, também são capazes de secretar uma série de citocinas e quimiocinas. Neste contexto, o papel dos astrócitos na neuroinflamação é inquestionável. Durante a neuroinflamação, diversas mudanças no perfil transcricional dos astrócitos podem levar a graves consequências, ocasionando em morte celular e dano tecidual. Sendo assim, utilizando ferramentas de bioinformática e avaliando vários repositórios de bancos de dados públicos atualmente disponíveis, o presente projeto visa empregar técnicas de meta-análise de expressão gênica e de redes de co-expressão para compreender melhor as interações moleculares observadas durante a neuroinflamação em doenças autoimunes e infecciosas do SNC, sobretudo avaliando genes relacionados aos astrócitos. Neste contexto, o projeto objetiva obter não só uma melhor compreensão das redes de conexão e de expressão gênica, como elencar possíveis alvos terapêuticos.
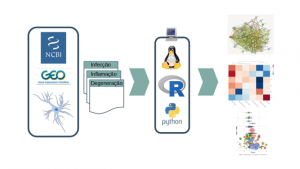
Figura. Esquema gráfico dos métodos. Sendo o projeto realizado exclusivamente em bioinformática, a partir de repositórios públicos como o GEO do NCBI, são obtidos datasets de astrócitos sob diferentes condições que são analisados com diversas ferramentas e pacotes quanto a, por exemplo, redes de interação gênica, genes diferencialmente expressos e enriquecimento de ontologias gênicas de interesse.
Doutorando: Tiago Francisco da Silva
Título: Avaliação da função do receptor NMDA em células progenitoras mielóides na Encefalomielite Autoimune Experimental
Resumo: Esclerose múltipla é uma doença autoimune, neuroinflamatória e neurodegenerativa que acomete principalmente jovens adultos, atingindo atualmente mais de 2 milhões de pessoas ao redor do mundo. Linfócitos T CD4, CD8 e monócitos, são os principais mediadores das lesões desmielinizantes características. O glutamato é o principal neurotransmissor excitatório do sistema nervoso central, participando em mais de 90% das sinapses excitatórias. Todavia, quando em excesso, pode induzir a morte de neurônios por excitotoxicidade mediada pelo receptor ionotrópico N-Metil-D-Aspartato (NMDAR). Ativação de NMDAR leva ao influxo de cálcio, fundamentais para diversas funções celulares como adesão, proliferação, migração, entre outras. De forma interessante, células imunes como linfocitos, macrófagos e neutrófilos também expressam NMDAR, todavia, sua função sobre o sistema ainda não é compreendida. Neste projeto buscamos avaliar o papel do NMDAR na modulação de células mielóides no contexto de neuroinflamação induzida pela encefalomielite experimental autoimune.
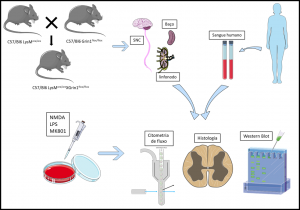
Figura. Esquematização metodológica para avaliação da função do receptor NMDA que reconhece o neurotransmissor Glutamato, este é secretado em excesso durante a neuroinflamação e a neurodegeneração. Para tanto, utilizaremos camundongos deficientes do receptor NMDA, além da inibição farmacológica in vitro das células de humanos e camundongos. Avaliaremos o espectro inflamatório e a desmielinização dos animais.
Doutoranda: Lilian Gomes de Oliveira
Título: Papel dos Complexos mTORC1 e mTORC2 em Astrócitos na Neurogênese e na Fisiopatogenia da Microcefalia Por Zika Vírus em Modelo Experimental Murino
Resumo: O Zika vírus (ZIKV) emergiu como problema de saúde mundial pois foi associado ao aumento de casos de microcefalia no Brasil entre 2015 e 2016, entretanto ainda pouco se sabe a respeito dos mecanismos utilizados pelo vírus para desencadear tal afecção. O ZIKV faz parte do gênero dos Flavivirus e possui interessante tropismo pelo sistema nervoso central (SNC), principalmente por células progenitoras neuronais (NPCs) e células da glia. Astrócitos são células da glia muito abundantes no SNC e atuam de maneira importante para a manutenção do metabolismo neuronal. Tal manutenção se dá principalmente pela produção de lactato, pela via glicolítica, que é importante substrato energético de neurônios. A ativação da glicólise pode ser dada via citocinas antivirais, tal como interferon (IFN) do tipo I, e pode ser crucial para manutenção do estado antiviral. Nessa via, o receptor de IFN tipo I (IFNAR) leva a ativação de AKT que por sua vez ativa importantes complexos que desempenham papel na tradução dos genes induzidos por interferon (ISGs) e na ativação da glicólise. Tais complexos são conhecidos como alvo mecanístico da rapamicina 1 e 2 (mTORC1 e mTORC2). Nesse contexto, já foi descrito que ZIKV é capaz de bloquear tanto a via de IFN do tipo I quanto a ativação de AKT-mTOR. Dessa maneira, é plausível pensar que ZIKV consegue antagonizar a resposta imune antiviral e ainda afetar a glicólise levando ao dano neuronal e replicação viral. Pensando nisso, o objetivo do presente projeto é caracterizar o papel dos astrócitos na fisiopatogenia da microcefalia causada pelo ZIKV focando o papel dos complexos mTORC1 e mTORC2 em modelo experimental murino. Os resultados obtidos poderão fornecer dados de extrema importância não só acerca dessa desconhecida infecção, mas também elucidar os mecanismos de lesão no SNC de bebês com microcefalia, os quais poderão alicerçar, principalmente, futuros estudos com foco em intervenção terapêutica.
REFERÊNCIAS
- Cugola, F. R. et al. The Brazilian Zika virus strain causes birth defects in experimental models. Nature 1–15 (2016). doi:10.1038/nature18296
- Larocca, R. A. et al. Vaccine protection against Zika virus from Brazil. Nature (2016). doi:10.1038/nature18952
- Abbink, P. et al. Protective efficacy of multiple vaccine platforms against Zika virus challenge in rhesus monkeys. 6157, 1–10 (2016).
- Bressanelli, S. et al. Structure of a flavivirus envelope glycoprotein in its low-pH-induced membrane fusion conformation. EMBO J. 23, 728–738 (2004).
- Hamel, R. et al. Biology of Zika Virus Infection in Human Skin Cells. 89, 8880–8896 (2015).
- Lazear HM, Govero J, Smith AM, Platt DJ, Fernandez E, Miner JJ, D. M. A Mouse Model of Zika Virus Pathogenesis. Cell Host Microbe S1931-3128, 30102 (2016).
- de Fatima Vasco Aragao, M. et al. Clinical features and neuroimaging (CT and MRI) findings in presumed Zika virus related congenital infection and microcephaly: retrospective case series study. Bmj 353, i1901 (2016).
- Peron, J. P. S. et al. Central Nervous System Resident Cells in Neuroinflammation : A Brave New World. (2012).
- Peron, J. P. S. et al. Human endometrial-derived mesenchymal stem cells suppress inflammation in the central nervous system of EAE mice. Stem Cell Rev. 8, 940–52 (2012).
- Brasil, P. et al. Zika Virus Outbreak in Rio de Janeiro, Brazil: Clinical Characterization, Epidemiological and Virological Aspects. PLoS Negl. Trop. Dis. 10, 1–13 (2016).
- Blake, A. et al. Guillain-Barré Syndrome outbreak associated with Zika virus infection in French Polynesia : a case-control study. Lancet 6736, (2016).
- Churlaud, G. et al. Human and Mouse CD8+CD25+FOXP3+ Regulatory T Cells at Steady State and during Interleukin-2 Therapy. Front. Immunol. 6, 2–11 (2015).
Copyright © 2024 Programa de Pós-Graduação em Imunologia | Produzido por SCS - Mídias Online


